Die vierte Elektronenschale besitzt mindestens acht Elektronen und kann maximal 18 Elektronen aufnehmen. Die äußerste (fünfte) Elektronenschale, auch Valenzschale genannt, kann zwischen ein und acht Elektronen aufnehmen. Somit befinden sich insgesamt 18 chemische Elemente in der fünften Periode.Hauptgruppe des periodischen Systems stehen die Elemente Kohlenstoff (C), Silicium (Si), Germanium (Ge), Zinn (Sn) und Blei (Pb). Diese Elemente besitzen 4 Außenelektronen, die sie an andere Elemente, wie Sauerstoff oder Halogene, abgeben können; daher sind sie in ihren Sauerstoffverbindungen maximal vierwertig.Als Beispiel für die Berechnung nehmen wir am besten das Element Chlor. Chlor hat die Ordnungszahl 17. Wenn Chlor nach außen ungeladen ist, heißt das, dass Chlor 17 Elektronen hat. Für Chlor gilt dann 17-2-8 = 7, es hat also 7 Außenelektronen.
Wie komme ich auf die elektronenzahl : Anzahl der Elektronen in der Atomhülle eines Atoms oder Ions. Bei neutralen Atomen ist die Elektronenzahl gleich der Ordnungszahl, also der Anzahl der im Atomkern enthaltenen Protonen. Bei einem positiven (einatomigen) Ion ist sie kleiner, bei einem negativen größer als die Ordnungszahl.
Wie viele Elektronen passen in die 1 Schale
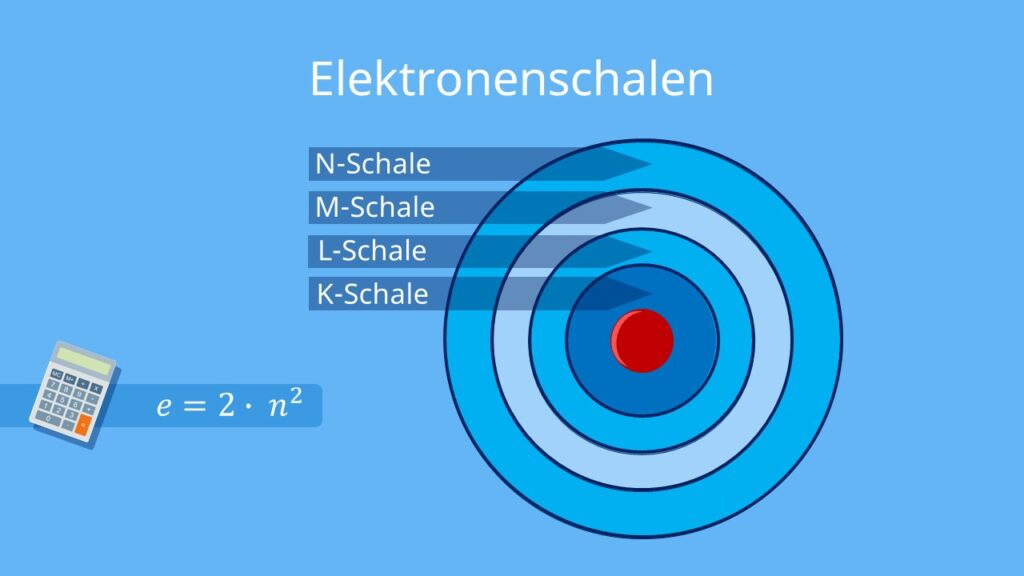
Die innerste Schale wird K-Schale genannt und fasst maximal zwei Elektronen; auf der nächsten Schale, der L-Schale, können maximal acht Elektronen untergebracht werden.
Warum erst 4s und dann 3d : Die 4s-Orbitale werden also vor den 3d-Orbitalen besetzt, weil sie energetisch tiefer liegen.
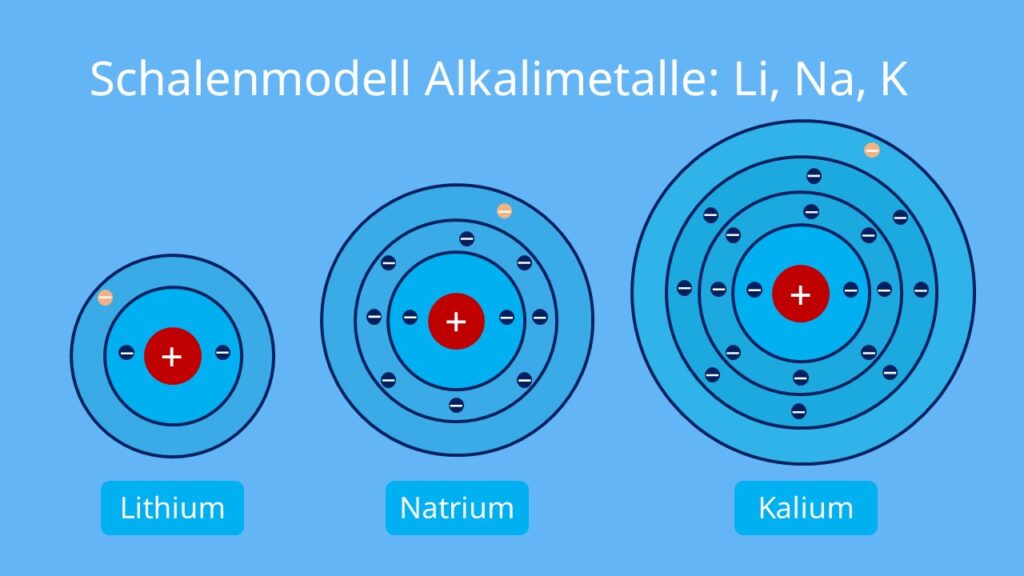
Kalium befindet sich im Periodensystem in der 4. Periode (die vierte Zeile im Periodensystem). Das bedeutet, dass seine Elektronen auf 4 Schalen aufgeteilt sind. Der englische Name des Kalium – potassium – leitet sich vom Wort Pottasche, dem Kaliumkarbonat, ab.
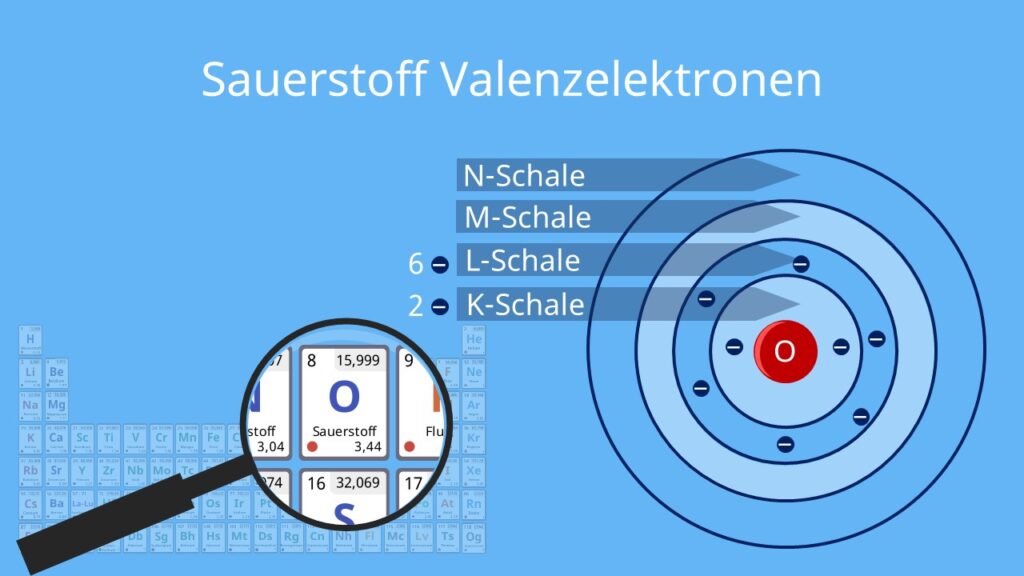
Die Elemente der 4. Hauptgruppe besitzen vier Außenelektronen, d. h. sie müssten vier Elektronen aufnehmen oder abgeben, um Edelgaskonfiguration mit acht Elektronen zu erreichen.
Wie viele Atome passen auf die 4 Schale
In der 4. Schale (N-Schale) sind maximal 32 Elektronen untergebracht (4s, 4p, 4d und 4f)N-Schale = 32 Elektronen. O-Schale = 50 Elektronen. P-Schale = 72 Elektronen. Q-Schale = 98 Elektronen.Die äußerste (siebente) Elektronenschale, auch Valenzschale genannt, kann zwischen ein und acht Elektronen aufnehmen. Somit befinden sich insgesamt 32 chemische Elemente in der siebente Periode.

zweite Schale: L-Schale, Platz für 8 Elektronen. dritte Schale: M-Schale, Platz für 18 Elektronen. vierte Schale: N-Schale, Platz für 32 Elektronen.
Wie viele Elektronen passen in die Schale : erste Schale: K-Schale, Platz für 2 Elektronen. zweite Schale: L-Schale, Platz für 8 Elektronen. dritte Schale: M-Schale, Platz für 18 Elektronen. vierte Schale: N-Schale, Platz für 32 Elektronen.
Wie viele Elektronen passen in eine Schale : N-Schale = 32 Elektronen. O-Schale = 50 Elektronen. P-Schale = 72 Elektronen. Q-Schale = 98 Elektronen.
Welche Schale wie viele Elektronen
erste Schale: K-Schale, Platz für 2 Elektronen. zweite Schale: L-Schale, Platz für 8 Elektronen. dritte Schale: M-Schale, Platz für 18 Elektronen. vierte Schale: N-Schale, Platz für 32 Elektronen.

Die Kohlenstoffgruppe ist die 4. Hauptgruppe im Periodensystem der Elemente. Zu dieser Gruppe gehören die Elemente Kohlenstoff (C), Silicium (Si), Germanium (Ge), Zinn (Zn) und Blei (Pb). Die Elemente dieser Gruppe werden auch Tetrele genannt.Alle Elemente der 4. Hauptgruppe besitzen vier Außenelektronen, wenn du dir ihre Atommodelle anschaust. Das heißt, dass sie entweder vier Elektronen aufnehmen oder abgeben müssen, um die Edelgaskonfiguration zu erreichen.
Wie viele Elektronen pro Schale Formel : In der äußersten Schale eines Atoms können sich maximal acht Elektronen aufhalten. Die maximal mögliche Anzahl von Elektronen für jede Schale kann man nach folgender Formel berechnen: Anzahl der Elektronen auf der Schale = 2• n2 (n steht für die Nummer der Schale.)
