
Die gute Herstellungspraxis – GMP – wird von der Pharma-, Lebensmittel- und Kosmetikindustrie angewendet, um Hygieneaspekte einzuhalten und Verbraucher zu schützen. Es ist ein Qualitätssicherungs-System für die Produktherstellung.Ist GMP Pflicht GMP ist für alle Hersteller verpflichtend, die ein Medikament zulassen und auf den Markt bringen wollen. Dabei gilt jedoch, dass die GMP-Richtlinien des Landes anzuwenden sind, in dem der Standort für dessen Herstellung liegt.Eine GMP-konforme Dokumentation besteht in der Regel aus Dokumenten, die anweisenden Charakter besitzen – zum Beispiel SOPs, Pläne etc. – und solchen Dokumenten, die belegen, dass in der Praxis gemäß den Anweisungen verfahren wurde (etwa Protokolle, Berichte).

Was ist GMP regulierten Umfeld : GMP sichert die Produktion im pharmazeutischen Umfeld.
Unter GMP („Good Manufacturing Practice“) versteht man die „Gute Herstellungspraxis für Arzneimittel“. Die GMP-Regeln sind in nationalen und internationalen Regelwerken festgeschrieben.
Wer überprüft GMP
Für die Überwachung der GMP-Anforderungen sind die GMP-Inspektorate der staatlichen Arzneimittelbehörden zuständig. Mögliche Verstöße können gravierende betriebliche Sanktionen wie Vertriebsstopps, Schließungen und sogar strafrechtliche Folgen möglich sind.
Was bedeutet GMP Erfahrung : GMP steht als Abkürzung für „Good Manufacturing Practice“ – zu Deutsch „Gute Herstellungspraxis“. Dahinter verbergen sich Regelwerke und Vorschriften, an die sich alle halten müssen, die besondere Produkte wie zum Beispiel Arzneimittel herstellen.
Arzneimittelhersteller benötigen diese Zertifikate oft für den Export, da der Zoll von nicht EU Ländern diese Zertifikate in der Regel anfordert. Daher werden WHO Zertifikate oft auch als Exportzertifikat bezeichnet.
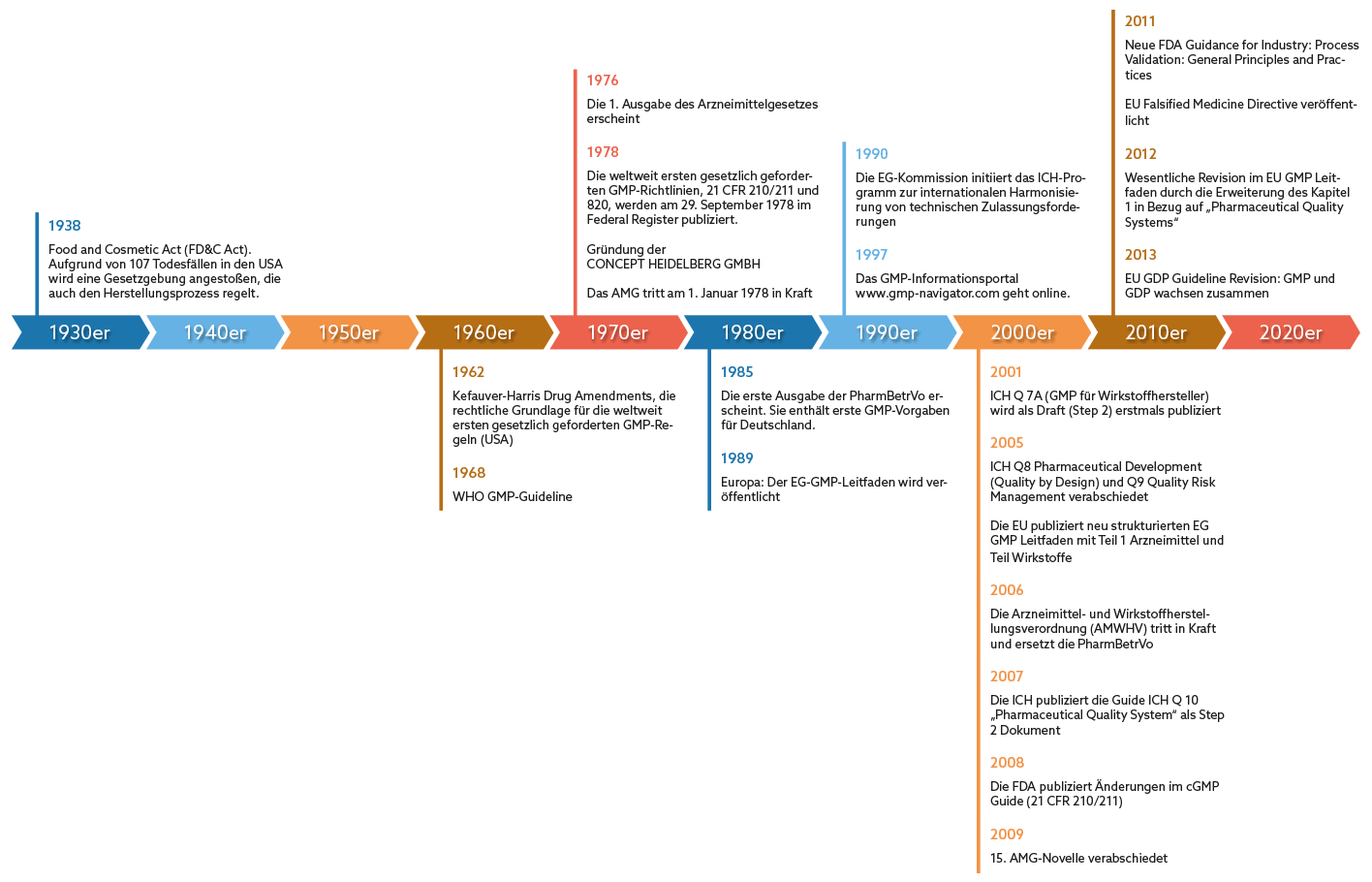
Der EU-GMP-Leitfaden (auch EG-GMP-Leitfaden) stellt die Richtlinien zur Qualitätssicherung bei Produktion, Equipment, Medien und Reinraumumgebung in der Produktion von Arzneimitteln und Wirkstoffen, aber auch bei Kosmetika, Lebens- und Futtermitteln dar.
Was kostet eine GMP Zertifizierung
Die Teilnahme an der Prüfung kostet € 190,- zzgl. Mwst.In § 2 Nummer 3 der AMWHV ist der EU-GMP-Leitfaden verankert und definiert. Das Bundesministerium für Gesundheit macht die jeweils aktuelle Fassung des Leitfadens in deutscher Sprache im Bundesanzeiger bekannt.In Deutschland ist die Anwendung der Guten Herstellungspraxis bei der Herstellung von Arzneimitteln und Wirkstoffen in der Arzneimittel- und Wirkstoffherstellungsverordnung (AMWHV) geregelt.
